Plateau immunomonitoring chez l’humain
Le plateau d’immunomonitoring chez l’humain (IMP) de l’Institut Toulousain des Maladies Infectieuses et Inflammatoires (INFINITy, Inserm UMR1291 – CNRS UMR5051 – Université de Toulouse) est spécialisé dans le stockage et l’analyse des cellules immunitaires humaines
Notre équipe / Contacts
Supervision du plateau : Raphaëlle ROMIEU-MOUREZ (PhD, raphaelle.romieu-mourez@inserm.fr)
Gestion des biobanques : Pierre Emmanuel PAULET (pierre-emmanuel-paulet@inserm.fr)
Responsable scientifique : Roland LIBLAU (MD PhD, roland.liblau@inserm.fr)
Email: imp.infinity@inserm.fr Phone: +33 5 62 74 86 66
Comité de pilotage
Claire CENAC (Eq. J-C. Guéry)
Maïlys MOUYSSET (Eq. M. Diaz)
Nathalie JONCA (Eq. M. Simon)
Emmanuel TREINER (Eq. A. Saoudi / R. Liblau)
Xavier IRIART (Eq. N. Blanchard)
Florence ABRAVANEL (Eq. J. Izopet / B. Lagane)
Romain TORRES (Eq. J. van Meerwijk / O. Joffre)
Nicolas FAZILLEAU (Eq. N. Fazilleau / S. Guerder)
Loïc DUPRE (Eq. R. Lesourne / L. Dupré)
Laurent GUILLEMINAULT (Eq. L. Reber)
Activités
BIOBANKING DE PBMC Y COMPRIS EN SITUATION CLINIQUE ET SUR ÉCHANTILLONS FRAGILES
BIOBANKING DE TISSUS LYMPHOÎDES
CONTRÔLES DE QUALITÉ ASSOCIÉS AU BIOBANKING
COMPTAGE ET VIABILITÉ AUTOMATISÉS DE CELLULES IMMUNITAIRES FRAÎCHES ET CRYOPRESERVÉES
ELISPOT
DOSAGE DE BIOMARQUEURS EN ELECTROCHIMILUMINESCENCE (TECHNOLOGIE MESO SCALE DISCOVERY)
IMMUNOMONITORING PHENOTYPIQUE ET FONCTIONNEL SUR COHORTES CLINIQUES
INFORMATION ET SUIVI RÉGLEMENTAIRE DE LA RECHERCHE SUR LA PERSONNE HUMAINE
Fonctionnement
Nos prestations, détaillées ci dessous sur cette page, se déclinent sous forme de services et de formations en biobanking et immunomonitoring chez l’homme dans nos locaux ou ceux de l’équipe demandeuse. Nos locaux techniques et nos procédures permettent la manipulation d’échantillons humains dans diverses situations cliniques, y compris en pathologie infectieuse.
Les demandes peuvent être adressées au plateau imp.infinity@inserm.fr
Nous fournissons des collections de PBMC et de cellules de tissus lymphoïdes de sujets sains créées et conservées localement pour un usage par les équipes et les plateaux d’INFINITY.
Services
Biobanking de PBMC, plasma, ADN et tissus lymphoïdes humains
 Prestation de biobanking de PBMC et de cellules immunitaires humaines ouverte à toute équipe publique ou privée
Prestation de biobanking de PBMC et de cellules immunitaires humaines ouverte à toute équipe publique ou privée
- Nous proposons l’isolement et la cryoconservation des cellules immunitaires humaines, y compris en milieu clinique et sur des échantillons fragiles. Des contrôles qualité (ex comptage et viabilité automatisés) sont proposés sur les échantillons frais et cryopréservés
- Les échantillons peuvent être reçus, traités et cryostockés dans notre laboratoire avant d’être expédiés au laboratoire du client
Collections internes
PBMC, plasma, ADN de sujets sains
- Les PBMC sont isolés de couches leuco-plaquettaires (partie non utilisée lors de la transfusion sanguine) provenant de dons de sang auprès de l’Établissement Français du Sang (EFS) en Occitanie.
- Les donneurs sont des volontaires adultes ayant fait un don de sang pour un usage thérapeutique en suivant la procédure mise en place par l’EFS. Les donneurs ont été jugés aptes à donner leur sang par un médecin de l’EFS. Chaque don est contrôlé pour l’absence de contre-indication permanente concernant les infections connues pour être transmissibles par le sang (hépatites virales, syphilis, infection par le VIH ou le HTLV).
- Le plateau met à disposition des ampoules congelées contenant chacune au minimum 15 millions de PBMC. Les plasma et l’ADN sont également conservés pour des analyses moléculaires.
- Entre 500 et 2000 ampoules sont utilisées chaque année pour des recherches sur l’homme par les équipes d’INFINITy. Environ 100 donneurs sont ajoutés à la banque annuellement afin d’obtenir un stock constant de PBMC provenant de plus de 350 personnes depuis 2015.
- Les PBMC sont caractérisés pour l’âge, le sexe, le groupe sanguin, le typage HLA-A2 et HLA-B7, la sérologie CMV et la sérologie toxoplasmose des donneurs.
Tissus lymphoïdes de sujets sains
- Une des collaborations scientifiques entre l’Inserm et le CHU de Toulouse est axée sur l’étude de tissus lymphoïdes pédiatriques de sujets sains, dont les fonctions et la composition cellulaire se distinguent du sang périphérique. Les tissus analysés sont des déchets opératoires d’amygdales et de thymus pédiatriques obtenus avec l’accord des familles informées de la recherche.
Simple et double ELISPOT et FLUOROSPOT
La réalisation des ELISPOT et/ou l’utilisation du lecteur ELISPOT sont proposés par le plateau en service, formation et en libre-service.

Test ELISPOT sur les PBMC d’un patient hospitalisé au CHU de Toulouse
La technologie et lecteur ELISPOT sont utilisés en routine sur le plateau dans le cadre d’études fondamentales ou cliniques, notamment en coordination avec le CHU de Toulouse.
Nous disposons d’un lecteur ELISPOT S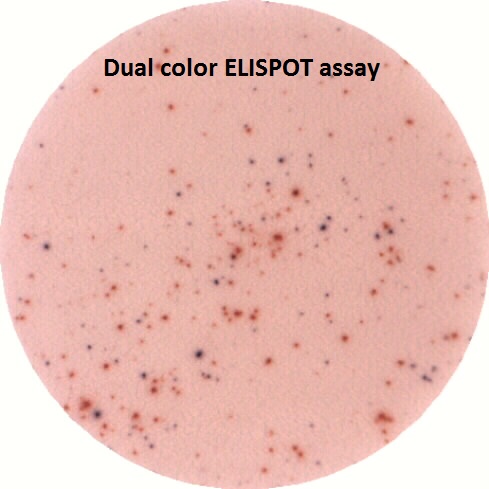 6 Ultra-V analyzer de Cellular Technology Ltd :
6 Ultra-V analyzer de Cellular Technology Ltd :
- Permet la lecture d’ELISPOT simples et doubles. Les substrats sont classiquement le BCIP/NBT (bleu) et/ou AEC (rouge). Les cellules formant les spots apparaitront bleues, rouges ou violet foncé, en fonction de leur marquage simple ou double
- Permet la lecture de Fluorospot simples et doubles. Les filtres sont FITC (verts) et/ou PE (rouge). Les cellules formant les spots fluoresceront en vert, rouge ou jaune, en fonction de leur marquage simple ou double
- S’adapte à toutes les plaques ELISPOT de 96 puits
Dosage de biomarqueurs en électrochimiluminescence (Meso Scale Discovery)

Nous proposons la quantification en libre-service, formation ou réalisation après étude du projet.
Le lecteur Quick Plex SQ120 et la technologie MSD permettent la quantification d’un large éventail de biomarqueurs humains et animaux (primates, rongeurs, chien).
Le site https://www.mesoscale.com/ recense les centaines de quantifications et multiplex possibles, tous adaptées au Quick Plex SQ120 :
- Le principe est l’ELISA en remplaçant la révélation colorimétrique par une révélation en électrochimiluminescence qui est sensible à cause de l’absence d’interférence entre le signal excitateur électrique et le signal émetteur lumineux. On obtient une limite inférieure de détection habituellement du picogramme/mL au femtogramme/mL et une excellente linéarité (5-log), le tout avec une possibilité de multiplexage (ex U-plex allant jusqu’à 10-plex)
- Il est possible d’adapter des tests ELISA existants au dosage en électrochimiluminescence
- Les analyses peuvent porter sur des substrats biologiques divers tels que plasma, sérum, surnageant cellulaire, broyat de tissus, liquide céphalorachidien
- Les dosages se réalisent sur plaques 96 puits complètes ou partielles avec moins de 25microL de substrat par dosage
Immunomonitoring phénotypique et fonctionnel sur échantillons cliniques
Nous effectuons à la demande de l’Immunomonitoring phénotypique et fonctionnel, y compris longitudinal, sur des échantillons frais ou cryopréservés.
Des prélèvements d’enfants asthmatiques suivis au CHU de Toulouse, de patients atteints d’une infection par le virus de l’hépatite E, de patients hospitalisés à la suite d’une infection par le virus Sars-CoV-2 et de patients atteints de narcolepsie ont été ainsi étudiés par le plateau.
Les études se réalisent classiquement en 2 phases :
- 1ere phase du projet : mise au point et validation des protocoles, souvent en s’appuyant sur la biobanque de sujets sains
- 2eme phase du projet : réalisation en routine des protocoles sur les cohortes cliniques ciblées
La durée de ces analyses est par essence variable, allant de quelques semaines à plusieurs mois avec une transmission des protocoles et savoir-faire aux équipes demandeuses.
Développement technologique en biobanking et immunomonitoring
Nous proposons l’étude de nouvelles techniques en biobanking et immunomonitoring, en incluant l’évaluation de leurs variations intra- et inter-expérimentales, à savoir entre les expérimentateurs et au cours du temps. Nous enseignons nos approches pour soutenir des recherches translationnelles et cliniques.
Des exemples incluent :
- Contrôles de qualité de biobanques de PBMC potentiellement fragiles (ex : échantillons transportés depuis d’autres régions de France, patients avec certaines pathologies pouvant affecter les cellules sanguines)
- Isolement de PBMC d’échantillons sanguins de faible volume en vue d’études pédiatriques
- Test de kits d’isolement de PBMC en comparaison avec les méthodologies classiques par Ficoll
- Comparaison de méthodes automatisées de comptage de PBMC frais ou cryopréservés
- Standardisation des analyses ELISPOT
- ELISPOT ex vivo sur PBMC frais en comparaison sur des PBMC cryopréservés
- Mise au point de profil cytométriques multiparamériques en lien avec le plateau cytométrie d’INFINITy
Information et réglementation liées à la recherche sur la personne humaine
Nous facilitons les démarches administratives incombant aux équipes de recherche pour assurer l’information auprès des patients et le respect du cadre éthique et légal de la recherche sur la personne humaine. Pour les projets promus par l’Inserm, nous faisons de plus le lien avec les spécialistes chargés des affaires réglementaires sur les tutelles CHU et Inserm.
Des exemples de notre activité incluent la rédaction de notices d’information de patients mineurs et majeurs et de consentement éclairé à des études cliniques, déclaration de collections d’échantillons biologiques humains auprès du MESR et du Comité de protection des personnes, organisation éthique, contractuelle et administrative de recherches portant sur des déchets opératoires du CHU.
Liens pour comprendre la législation relative à la recherche sur la personne humaine en France :
- Ordonnance de 2016 relative à la loi Jardé : consulter C. santé publ. Partie législative, Première partie : Protection générale de la santé, Livre Ier : Protection des personnes en matière de santé, Titre II : Recherches impliquant la personne humaine, Chapitre I à IV
- Les recherches sur la personne humaine doivent assurer la confidentialité des données personnelles (Loi n° 78-17 du 6 janvier 1978 relative à l’informatique, aux fichiers et aux libertés). La plupart des projets doivent être déclarés à ou autorisés par la Commission Informatique et Liberté (CNIL): https://www.cnil.fr/fr/
- Pour obtenir la promotion d’un projet par l’INSERM https://www.inserm.fr/professionnels-recherche/recherche-sur-personnes/soumission-projets-impliquant-personne-humaine
- Questions/réponses sur le site Ministère des Solidarités et de la santé https://solidarites-sante.gouv.fr/systeme-de-sante-et-medico-social/recherche-et-innovation/recherches-impliquant-la-personne-humaine/
Publications auteur, contributeur ou détaillant les biobanques du plateau
Immunomonitoring sur cohortes cliniques et sujets sains; développement technlogique
- Humoral and Cellular Immune Responses of Solid Organ Transplant Patients on Belatacept to Three Doses of mRNA-Based Anti-SARS-CoV-2 Vaccine. Abravanel F, Marion O, Del Bello A, Beunon T, Romieu-Mourez R, Couat C, Pucelle M, Staes L, Guitard J, Esposito L, Faguer S, Kamar N, Izopet J. Vaccines (Basel). 2022 Feb 24;10(3):354
- Assessment of 4 Doses of SARS-CoV-2 Messenger RNA-Based Vaccine in Recipients of a Solid Organ Transplant. Kamar N, Abravanel F, Marion O, Romieu-Mourez R, Couat C, Del Bello A, Izopet J.JAMA Netw Open. 2021 Nov 1;4(11):e2136030
- Separation of the CaV 1.2-CaV 1.3 calcium channel duo prevents type 2 allergic airway inflammation. Giang N, Mars M, Moreau M, Mejia JE, Bouchaud G, Magnan A, Michelet M, Ronsin B, Murphy GG, Striessnig J, Guéry JC, Pelletier L, Savignac M. Allergy. 2022 Feb;77(2):525-539
- Circulating follicular helper T cells exhibit reduced ICOS expression and impaired function in narcolepsy type 1 patients. Nguyen XH, Dauvilliers Y, Quériault C, Perals C, Romieu-Mourez R, Paulet PE, Bernard- Valnet R, Fazilleau N, Liblau R. J Autoimmun. 2018 Nov;94:134-142
- Conventional and innate lymphocytes response at the acute phase of HEV infection in transplanted patients. Abravanel F, Barragué H, Dörr G, Sauné K, Péron JM, Alric L, Kamar N, Izopet J, Champagne E.J Infect. 2016 Jun;72(6):723-730
Biobanking de PBMC, plasma, DNA et de tissu lymphoïde
-
Increased levels of circulating soluble CD226 in multiple sclerosis.Kari S, Bucciarelli F, Angles T, Oster AC, Cauboue P, Laviolette K, Mougenot M, Morandi E, Bernard I, Pignolet B, Bost C, Thomas J, Nogueira L, Saoudi A, Liblau R, Astier AL. Mult Scler. 2024 Feb 29:13524585241234489
- Coordinated ARP2/3 and glycolytic activities regulate the morphological and functional fitness of human CD8+ T cells. Kamnev A, Mehta T, Wielscher M, Chaves B, Lacouture C, Mautner AK, Shaw LE, Caldera M, Menche J, Weninger WP, Farlik M, Boztug K, Dupré L. Cell Rep. 2024 Mar 26;43(3):113853
- Lymphocyte migration and retention properties affected by ibrutinib in chronic lymphocytic leukemia. Rey-Barroso J, Munaretto A, Rouquié N, Mougel A, Chassan M, Gadat S, Dewingle O, Poincloux R, Cadot S, Ysebaert L, Quillet-Mary A, Dupré L. Haematologica. 2024 Mar 1;109(3):809-823
- Eomes-dependent mitochondrial regulation promotes survival of pathogenic CD4+ T cells during inflammation. Joulia E, Michieletto MF, Agesta A, Peillex C, Girault V, Le Dorze AL, Peroceschi R, Bucciarelli F, Szelechowski M, Chaubet A, Hakim N, Marrocco R, Lhuillier E, Lebeurrier M, Argüello RJ, Saoudi A, El Costa H, Adoue V, Walzer T, Sarry JE, Dejean AS. J Exp Med. 2024 Feb 5;221(2):e20230449
- Increased levels of circulating soluble CD226 in multiple sclerosis. Kari S, Bucciarelli F, Angles T, Oster AC, Cauboue P, Laviolette K, Mougenot M, Morandi E, Bernard I, Pignolet B, Bost C, Thomas J, Nogueira L, Saoudi A, Liblau R, Astier AL. Mult Scler. 2024 Feb 29:13524585241234489
- Human papilloma virus-16-specific CD8+ T-cell expansions characterize different clinical forms of lichen planus and not lichen sclerosus et atrophicus. Viguier M, Pérals C, Poirier B, Battistella M, Aubin F, Bachelez H, Prétet JL, Gheit T, Tommasino M, Touzé A, Gougeon ML, Fazilleau N.Exp Dermatol. 2023 Mar 15
- Human papilloma virus-16-specific CD8+ T-cell expansions characterize different clinical forms of lichen planus and not lichen sclerosus et atrophicus. Viguier M, Pérals C, Poirier B, Battistella M, Aubin F, Bachelez H, Prétet JL, Gheit T, Tommasino M, Touzé A, Gougeon ML, Fazilleau N.Exp Dermatol. 2023 Mar 15
- HIV-1 infection enhances innate function and TLR7 expression in female plasmacytoid dendritic cells. Abbas F, Cenac C, Youness A, Azar P, Delobel P, Guéry JC.Life Sci Alliance. 2022 Sep 2;5(10):e202201452
- Effector memory CD8 T cell response elicits Hepatitis E Virus genotype 3 pathogenesis in the elderly El Costa H, Gouilly J, Abravanel F, Bahraoui E, Peron J-M, Kamar N, Jabrane-Ferrat N, Izopet J PLoS Pathog. 2021 Feb; 17(2): e1009367
- Hydroxychloroquine inhibits proteolytic processing of endogenous TLR7 protein in human primary plasmacytoid dendritic cells. Cenac C, Ducatez MF, Guéry JC. Eur J Immunol. 2022 Jan;52(1):54-61
- TLR7 dosage polymorphism shapes interferogenesis and HIV-1 acute viremia in women. Azar P, Mejía JE, Cenac C, Shaiykova A, Youness A, Laffont S, Essat A, Izopet J, Passaes C, Müller-Trutwin M, Delobel P, Meyer L, Guéry JC. JCI Insight. 2020 Jun 18;5(12):e136047
- The costimulatory molecule CD226 signals through VAV1 to amplify TCR signals and promote IL-17 production by CD4+ T cells. Gaud G, Roncagalli R, Chaoui K, Bernard I, Familiades J, Colacios C, Kassem S, Monsarrat B, Burlet-Schiltz O, de Peredo AG, Malissen B, Saoudi A. Sci Signal. 2018 Jul 10;11(538):eaar3083
- TLR7 escapes X chromosome inactivation in immune cells. Souyris M, Cenac C, Azar P, Daviaud D, Canivet A, Grunenwald S, Pienkowski C, Chaumeil J, Mejía JE, Guéry JC Sci Immunol. 2018 Jan 26;3(19)
- High-Dimensional Single-Cell Analysis Reveals The Immune Signature of Narcolepsy. F.J. Hartmann, R. Bernard-Valnet, C. Quériault, D. Mrdjen, L.M. Weber, E. Galli, C. Krieg, M.D. Robinson, X-H. Nguyen, Y. Dauvilliers, R.S. Liblau* & B. Becher*. J. Exp. Med. 2016 Nov 14;213(12):2621-2633
Contact, formulaires et réservation
– Afin d’accéder aux biobanques internes pour les équipes et les plateaux d’INFINITy, il suffit de nous envoyer par courriel un des formulaires de demande disponible sur l’intranet en respectant les délais et les procédures indiqués sur ces formulaires.
– La réservation du Quick Plex SQ120 Meso Scale Discovery (formation obligatoire) se fait en ligne https://www.infinity.inserm.fr/reservations/ (section « Appareils »), en indiquant si vous souhaitez emprunter l’agitateur thermostaté.
– Les autres équipements sont accessibles sans réservation.
Autres informations
Facturation
Protocoles et manuels techniques
Les documents sont disponibles sur requête à imp.infinity@inserm.fr
PBMC isolation and cryopreservation
PBMC thawing
Fresh and cryopreserved human immune cell counting (BT20 counter, Cellometer auto2000 counter, LUNA-FL counter, cytometry)
ELISPOT technology to numerate effector memory T cells
Booklet « ELISPOT reader »
Booklet « Introduction to Meso Scale Discovery technology and Quick Plex SQ120 reader for the dosage of biomarkers »

