Auteurs: Marcy Belloy#, Benjamin A M Schmitt#, Florent H Marty , Charlotte Paut , Emilie Bassot , Amel Aïda , Marine Alis , Margot Zahm , Adeline Chaubet, Hugo Garnier , Thelma Flores-Aguilar , Elisa Roitg , Renzo Gutierrez-Loli , Sophie Allart , Romain Ecalard, Raphaël Boursereau , Gaëtan Ligat , Daniel Gonzalez-Dunia, Nicolas Blanchard , Elsa Suberbielle
Lorsque des processus inflammatoires se produisent à l’intérieur du cerveau, on parle de neuroinflammation. Depuis plusieurs années, il est établi que la neuroinflammation peut perturber le fonctionnement du cerveau. La neuroinflammation est ainsi souvent associée aux maladies neurodégénératives, elle peut être aussi provoquée par des infections, telles que le virus SARS-CoV2 ou le parasite Toxoplasma gondii. Ce parasite T. gondii, qui persiste à l’intérieur des neurones, génère une neuroinflammation chronique et à bas bruit et il est responsable de divers troubles cognitifs. Néanmoins, la nature des signaux inflammatoires impliqués dans ces altérations cognitives, et les mécanismes liant neuroinflammation et dysfonctionnement neuronal, restent assez mal compris.
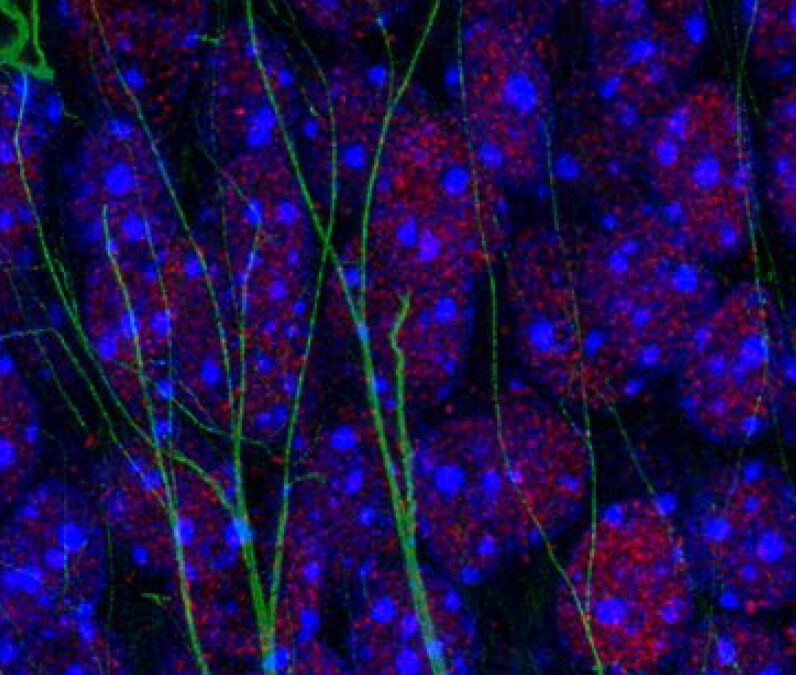
Des découvertes récentes ont montré que la mémoire spatiale (qui permet par exemple de se souvenir d’une expérience dans son contexte, et de retrouver son chemin) repose sur un équilibre fin entre cassures et réparations de l’ADN dans les neurones. Ce mécanisme, dit épigénétique car il modifie la structure de l’ADN et pas sa séquence, est essentiel pour un fonctionnement optimal des neurones, en particulier ceux de la région du cerveau appelée hippocampe, qui assure la mémoire spatiale.
Une équipe de neuroscientifiques (menés par Elsa Suberbielle) et d’immunologistes (menés par Nicolas Blanchard) de l’Institut Toulousain des Maladies Infectieuses et Inflammatoires (Infinity), ont fait le lien entre défauts de mémoire spatiale causés par l’infection à T. gondii et déséquilibre du processus de réponses aux cassures de l’ADN dans les neurones. Ils ont identifié un signal inflammatoire (une cytokine appelée interleukine 1) impliqué dans le déficit de mémoire spatiale, et mis en lumière la capacité de ce signal d’origine immunitaire à perturber l’équilibre épigénétique de certains neurones, fournissant ainsi la 1ère explication moléculaire aux perturbations de la mémoire causée par cette parasitose chronique.
En manipulant dans des modèles expérimentaux la réponse aux cassures de l’ADN ou les récepteurs de ces signaux inflammatoires sur les neurones, ils sont parvenus à prévenir les troubles de la mémoire, même lorsqu’ils sont engendrés dans le cadre d’une inflammation plus forte du cerveau.
Ces travaux, publiés dans le journal Nature Neuroscience, ont de potentielles répercussions au-delà de l’infection à T. gondii, car l’interleukine 1 est un signal communément augmenté lors de nombreuses maladies inflammatoires chroniques. Ces résultats pourraient suggérer de nouvelles pistes thérapeutiques pour le traitement de déficits mnésiques, dans le cadre par exemple, de la dépression ou de maladies neurodegénératives.
Lien vers l’article https://pubmed.ncbi.nlm.nih.gov/40841478/